FAST4WARD-Studie
FAST4WARD (eFficAcy and Safety of cerTolizumab Pegol – 4 Weekly dosAge in RheumatoiD arthritis) ist eine 24-wöchige, zulassungsrelevante, randomisierte, doppelblinde, placebo-kontrollierte internationale multizentrische Phase-III-Studie zur Prüfung der Wirksamkeit und Verträglichkeit von Certolizumab Pegol (Cimzia) in der Monotherapie (400 mg alle 4 Wochen) im Vergleich zu Placebo bei Patienten mit einer aktiven rheumatoiden Arthritis (RA) nach vorhergehendem DMARD-Versagen.
Studienziele waren die Verbesserung der klinischen Symptome einer aktiven RA sowie die Verbesserung der Funktionskapazität und Erschöpfung sowie insgesamt der Lebensqualität.
Als primärer Endpunkt wurde die ACR-20-Responder-Rate in Woche 24 definiert.
Sekundäre Endpunkte waren
- die ACR-50- und ACR-70-Responder-Raten in Woche 24
- die Einzelkomponenten des ACR-Core-Sets in Woche 24
- das DAS-28-Ansprechen in Woche 24
- die Verbesserung der Funktionskapazität in Woche 24 (gemessen im HAQ-DI)
- die Verbesserung von Müdigkeit und Erschöpfung („fatigue“) in Woche 24 (gemessen mit der Fatigue Assessment Scale, FAS)
- die Verbesserung der Lebensqualität in Woche 24 (gemessen im SF-36).
Aufgenommen in die Studie wurden 220 erwachsene RA-Patienten im Alter zwischen 18 und 75 Jahren (Klassifikation der RA nach den ACR-Kriterien von 1987)) mit einer Krankheitsdauer von ≥ 6 Monaten und unzureichendem Ansprechen auf mindestens ein konventionelles DMARD (disease modifying antirheumatic drug, krankheitsmodifizierendes Medikament). Alle Patienten mussten eine aktive Erkrankung aufweisen, definiert durch mindestens 9 (von 68) druckschmerzhafte Gelenke, mindestens 9 (von 68) geschwollene Gelenke, eine Morgensteifigkeit ≥ 45 Minuten, eine BSG (nach Westergren) von ≥ 28 mm/h oder ein CRP von > 10 mg/l.
Die Patienten hatten zuvor auf eine ausreichend lange durchgeführte und ausreichend hoch dosierte Therapie mit konventionellen langwirksamen Antirheumatika einschließlich Methotrexat (MTX) nicht oder nicht ausreichend angesprochen. DMARDs wurden mindestens 28 Tage oder 5 Halbwertszeiten vor Studienbeginn abgesetzt; im Fall einer Leflunomid-Therapie wurde ein Auswaschverfahren mit Cholestyramin durchgeführt.
Ein Ausschlußgrund für die Aufnahme in die Studie war eine unmittelbar vorausgegangene Therapie mit einem anderen Biologikum (im Zeitraum von 6 Monaten vorher) oder eine Therapie mit einem TNF-alpha-Blocker in der Anamnese.
Eine Therapie mit Cortison war erlaubt, wobei ein Prednison-Äquivalent von ≤ 10 mg/Tag nicht überschritten werden durfte.
Die Patienten wurden in einem Verhältnis von 1:1 auf die zwei Studienarme aufgeteilt („randomisiert“):
- 111 Patienten erhielten Certolizumab Pegol (CPZ) in einer Lyophilisat-Präparation in einer Dosis von 400 mg alle 4 Wochen
- 109 Patienten erhielten alle 4 Wochen Placebo.
Patienten, die nach 12 Wochen kein ACR-20-Ansprechen erreicht hatten, wurden als Therapieversager klassifiziert und schieden aus dem ursprünglichen Behandlungsprotokoll aus. Sie hatten allerdings die Möglichkeit, in eine offene Studie (open-label-Extensions-Studie) aufgenommen zu werden und bekamen dann ab der 16. Woche 400 mg Certolizumab Pegol alle 4 Wochen.
Zu Studienbeginn wiesen die Patienten mit durchschnittlich etwa 53 Jahren das typische Alter auf, das man in vergleichbaren Studienpopulationen sieht. Im Mittel lag die Krankheitsdauer bei mehr als 9 Jahren, d.h. die Erkrankung war zu diesem Zeitpunkt bereits erheblich fortgeschritten. Neben MTX waren die Patienten vor Einschluß in die Studie in der Regel mit einem weiteren DMARD vorbehandelt worden. Mehr als ¾ der Patienten waren seropositiv (Rheumafaktor-positiv). Die mittlere MTX-Dosis betrug 13,5 mg pro Woche.
Die Erkrankung war vor Beginn der Studie mit durchschnittlich knapp 30 druckschmerzhaften und knapp 20 geschwollenen Gelenken hochaktiv; dies spiegelt sich auch in einem hohen DAS-28 von 6,3 Einheiten und in einer hohen systemischen Entzündungsaktivität wieder (CRP 11,3 bzw. 11,6 mg/l, BSG 36 bzw. 31 mm/h n.W.; Placebo bzw. Certolizumab Pegol).
Mit einem HAQ-DI von 1.6 bzw. 1,4 (Placebo/Certolizumab) war die Funktionskapazität bereits erheblich eingeschränkt.
Nach einem Behandlungszeitraum von 24 Wochen erreichten 45,5% der Patienten unter Certolizumab Pegol ein ACR-20-Ansprechen gegenüber nur 9,3% der Patienten in der Placebo-Gruppe. Nur eine geringe Zahl der Patienten in der Placebo-Gruppe erreichten ein ACR-50- und ACR-70-Ansprechen (3,7% bzw.0%); unter Certolizumab betrugen diese Raten 22,7%/für ACR-50 sowie 5,5% für die ACR-70-Response.
Die Wirkung der Certolizumab-MTX-Kombination trat sehr schnell ein. Ein signifikanter Unterschied im ACR-20-Ansprechen zeigte sich bereits nach einer Woche. Ebenso war bereits nach einer Woche ein signifikanter Rückgang bei der Zahl geschwollener und bei der Zahl schmerzhafter Gelenke zu beobachten.
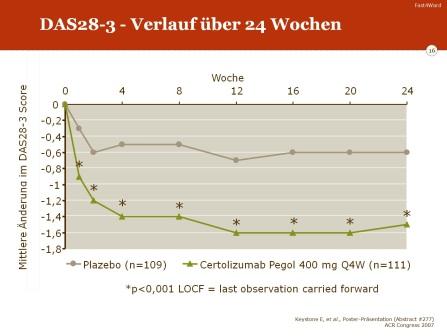
Im DAS-28 kam es unter der Therapie mit Certolizumab Pegol zu einer signifikanten Verbesserung. Nach 24 Wochen betrug die mittlere Änderung -1,5 (entsprechend einem Rückgang des DAS-28 von 6.3 auf 4.8) gegenüber einer Änderung unter Placebo von lediglich −0.6 (entsprechend einem Rückgang des DAS-28 von 6.3 auf 5.7).
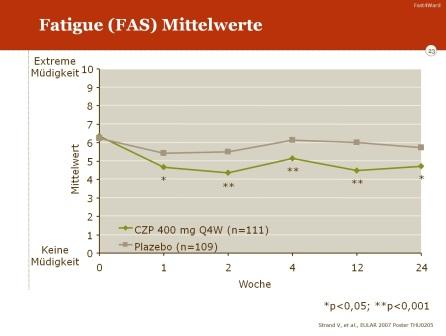
Eine signifikante Verbesserung im Vergleich zu Placebo war auch für weitere klinische Parameter zu verzeichnen: Reduktion der Schmerzen, Abnahme von Müdigkeit und Erschöpfung („fatigue“) sowie insgesamt eine Zunahme der Lebensqualität.
Parallel zum klinischen Ansprechen sieht man unter der Certolizumab-MTX-Kombination eine deutliche Besserung der funktionellen Kapazität, d.h. eine Abnahme der krankheitsbedingten Behinderung.
Die Verträglichkeit und Sicherheit von Certolizumab Pegol entsprach in der FAST4WARD-Studie den Daten, die auch von den anderen TNF-alpha-Blockern bekannt sind.
Nennenswerte unerwünschte Wirkungen waren eine etwas erhöhte Infektionsrate einschließlich schwerwiegender Infektionen. Tuberkulosefälle wurden in dieser Studie nicht beobachtet. Die Infektionen betrafen zumeist die oberen Luftwege (Erkältungen, Nebenhöhlenentzündungen, Bronchitis) sowie den Urogenitaltrakt (Harnwegsinfekte).
Hinsichtlich der Verträglichkeit erwähnenswert ist die unter Certolizumab Pegol im Vergleich mit anderen, subkutan verabreichten Medikamenten sehr niedrige Rate an lokalen Reaktionen am Injektionsort.
Referenz:
Fleischmann R, Vencovsky J, van Vollenhoven RF, Borenstein D, Box J, Coteur G, Goel N, Brezinschek HP, Innes A, Strand V.
Efficacy and safety of certolizumab Pegol monotherapy every 4 weeks in patients with rheumatoid arthritis failing previous disease-modifying antirheumatic therapy: the FAST4WARD study.
Ann Rheum Dis. 2009 Jun;68(6):805-11. Epub 2008 Nov 17.
Abstract
Volltext