Umgedrehte Peptide im Immunsystem
Die Ursachen von Autoimmunerkrankungen sind molekular weitgehend unverstanden. Umso wichtiger ist es, dass Wissenschaftler weitere Erkenntnisse über die Funktionsweise unseres Immunsystems gewinnen. Wissenschaftler des Leibniz-Instituts für Molekulare Pharmakologie (FMP) haben in diesem Zusammenhang ein Phänomen entdeckt, das sämtliche Forscherkollegen bisher übersehen haben.
Sie konnten zeigen, dass Peptide auf den Oberflächen von sogenannten MHC-Molekülen nicht nur in einer Richtung, sondern auch um 180° gedreht präsentiert werden können. Dies könnte vom Immunsystem als Angriffssignal verstanden werden. Sie berichten darüber in der aktuellen Online-Ausgabe von PNAS (Proceedings of the National Academy of Science of the United States of America).
Wenn Erreger in den Körper eindringen, werden sie von Fresszellen des Immunsystems aufgenommen und in kurze Peptidschnipsel, die man Antigene nennt, zerlegt. Die Fresszellen enthalten zudem Proteine des Major Histocompatibility Complex Klasse II (MHCII).
Die MHCII-Moleküle verbinden sich mit den Peptidschnipseln und schieben sie an die Zelloberfläche. Dort präsentieren sie diese wie eine Flagge anderen Immunzellen, den sogenannten T-Helferzellen. Die T-Helferzellen schließlich docken an den MHCII-Komplex samt Antigen an und lösen damit eine umfassende Immunantwort aus, wodurch die Eindringlinge im Körper schließlich vernichtet werden.
Hat der MHCII-Komplex nichts zu tun, wird seine Bindungsstelle durch ein eigens dafür zuständiges körpereigenes Peptid mit Namen CLIP geschützt. Dieses passt exakt in die Bindungstasche des MHCII-Komplexes.
Aber auch andere körpereigene Peptide werden von den MHCII-Komplexen auf der Zelloberfläche präsentiert. Die T-Helferzellen haben nun im Laufe ihrer Reifung gelernt, die körpereigenen Peptide zu tolerieren und nicht anzugreifen. Wird diese Toleranz gebrochen kann es zu Autoimmunerkrankungen kommen. Der Präsentation von Peptiden auf der Zelloberfläche kommt also eine wesentliche Bedeutung bei Reaktionen des Immunsystems zu.
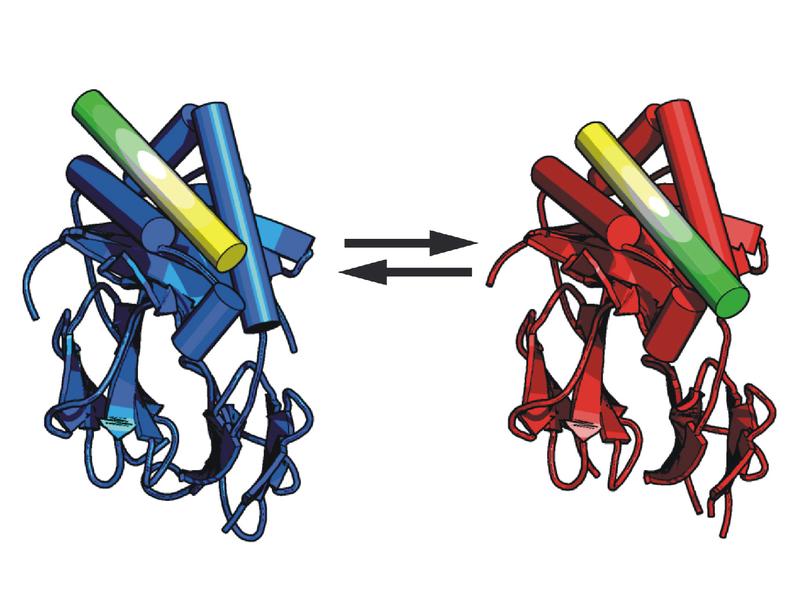
Die FMP-Forscher unter der Leitung von Christian Freund haben in diesem Zusammenhang eine entscheidende Entdeckung gemacht: Sie konnten zeigen, dass CLIP-Peptide in zwei verschiedenen Ausrichtungen in der Bindungstasche des MHC-Komplexes liegen können.
„Auf Grund der Molekülstruktur des MHC-Komplexes und der CLIPs ist man bislang davon ausgegangen, dass es nur eine bestimmte Ausrichtung von CLIP und allen anderen Antigenen im Komplex geben kann. Niemand hat aber je nachgeschaut, ob das wirklich so sein muss“, sagt Christian Freund.
Untersuchungen mit Röntgenstrukturanalyse und NMR-Spektroskopie haben nun gezeigt, dass das längliche CLIP-Molekül auch invertiert im MHC-Komplex eingebettet sein kann, so als würde man im Bett mit den Füßen auf dem Kopfkissen liegen.
Mittels NMR konnten die Forscher das Umdrehen des CLIP-Peptids direkt beobachten. Andere Untersuchungen zeigten, dass das verkehrt herum liegende CLIP alle Eigenschaften eines funktionstüchtigen MHC-II-Peptidkomplexes hat und so theoretisch auch von T-Helferzellen erkannt werden kann.
Die Forscher haben Hinweise darauf, dass dieses Phänomen der zwei Ausrichtungen auch für andere körpereigene Peptide zutrifft. Und hier liegt auch die Brisanz ihrer Entdeckung. Für Christian Freund könnte dies ein Schlüssel zur Erklärung von fehlgeleiteten Immunprozessen sein: „Wenn T-Helferzellen aus irgendeinem Grund gelernt haben, nur die eine Ausrichtung im Komplex zu erkennen, kann es sein, dass sie die andere Ausrichtung als fremd einstufen und somit eine Immunreaktion auslösen“, sagt er.
Gemeinsam mit internationalen Kooperationspartnern wollen die Forscher nun herausfinden, ob und wo im Organismus solche ungewöhnlichen MHCII-Komplexe auftreten und inwieweit sie eine Rolle bei organspezifischen Autoimmunerkrankungen wie etwa Typ I Diabetes mellitus oder der Multiplen Sklerose spielen.
Quellen:
Dr. Christian Freund,
Leibniz-Institut für Molekulare Pharmakologie (FMP),
Robert-Rössle-Str. 10,
13125 Berlin
Forschungsverbund Berlin e.V.
Christine Vollgraf, Pressestelle des Forschungsverbundes Berlin e.V.
Rudower Chaussee 17
12489 Berlin
http://idw-online.de/pages/de/news398126: